Seitenpfad:
- Presse
- Pressemeldungen 2012
- 07.11.2012 Bremer WissenschaftlerInnen lüften ...
07.11.2012 Bremer WissenschaftlerInnen lüften Rätsel um den Methanabbau im Meeresboden
Mikrobiologen und Geochemiker des Max-Planck-Instituts für Marine Mikrobiologie haben zusammen mit ihren Kollegen aus Wien und Mainz gezeigt, dass die anaerobe Methanoxidation im Meeresboden von einem einzigen Mikroorganismus ausgeführt werden kann, der zur Domäne der Archaeen gehört. Die anaerobe Methanoxidation ist an Sulfatveratmung gekoppelt, die entgegen früherer Annahmen nicht von einem vergesellschafteten Bakterium durchgeführt werden muss. Ihre Entdeckung veröffentlichten die Wissenschaftler als Artikel in der renommierten Fachzeitschrift Nature.
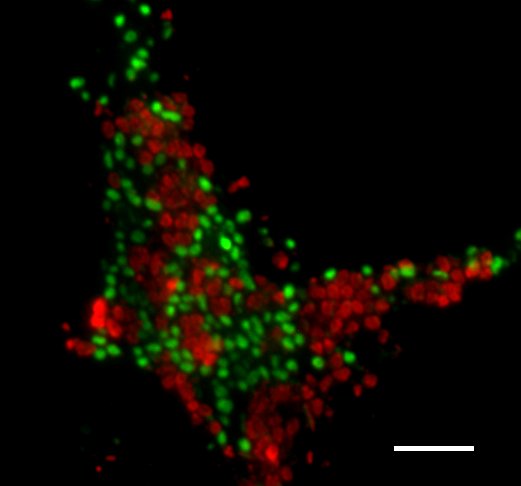
Die Anreicherungskulturen mit den AOM-Organismen, hier die Archaeen in rot und die Bakterien in grün, stammen ursprünglich vom Schlammvulkan Isis im Mittelmeer. Acht Jahre lang haben die WissenschaftlerInnen die Mikroorganismen in der Probe angereichert. Es hat sich gelohnt: Ohne diese Kulturen wäre es nicht möglich gewesen, den komplizierten Schwefelkreislauf der AOM zu entschlüsseln. (Photo: Jana Milucka)
Große Mengen Methan lagern unter dem Meeresboden. Die an Sulfatveratmung gekoppelte anaerobe Oxidation von Methan (AOM) verhindert ein Austreten des Treibhausgases in die Atmosphäre. Obwohl der Stoffwechselprozess bereits vor 35 Jahren entdeckt wurde, gab die Frage, wie genau die beteiligten Mikroben diese Reaktion durchführen, lange Rätsel auf. Vor einem Jahrzehnt machten WissenschaftlerInnen die wichtige Entdeckung, dass bei der AOM häufig zwei verschiedene Gruppen von Mikroorganismen ein Konsortium bilden. Dies führte zu der Annahme, dass diese zwei Organismengruppen verschiedene Teilreaktionen der AOM-Reaktion ausführen. Dem einen, einem Archaeon, wurde die Rolle des Methanoxidierers zugeschrieben, dem anderen, einem Bakterium, die der Sulfatveratmung. Dabei ging man davon aus, dass ein Zwischenprodukt von den methanabbauenden Archaeen zu den sulfatveratmenden Bakterien übertragen wird.
Nun hat das Team um Professor Marcel Kuypers dieses Modell auf den Kopf gestellt. Die WissenschaftlerInnen konnten zeigen, dass das Archaeon nicht nur Methan oxidiert, sondern auch das Sulfat verbraucht und dabei ohne den bakteriellen Partner auskommt. Allerdings nutzen sie dazu nicht die Enzymausstattung, wie sie andere bekannte sulfatreduzierende Mikroorganismen haben, sondern vermutlich einen anderen, bisher unbekannten Stoffwechselweg.
Nun hat das Team um Professor Marcel Kuypers dieses Modell auf den Kopf gestellt. Die WissenschaftlerInnen konnten zeigen, dass das Archaeon nicht nur Methan oxidiert, sondern auch das Sulfat verbraucht und dabei ohne den bakteriellen Partner auskommt. Allerdings nutzen sie dazu nicht die Enzymausstattung, wie sie andere bekannte sulfatreduzierende Mikroorganismen haben, sondern vermutlich einen anderen, bisher unbekannten Stoffwechselweg.
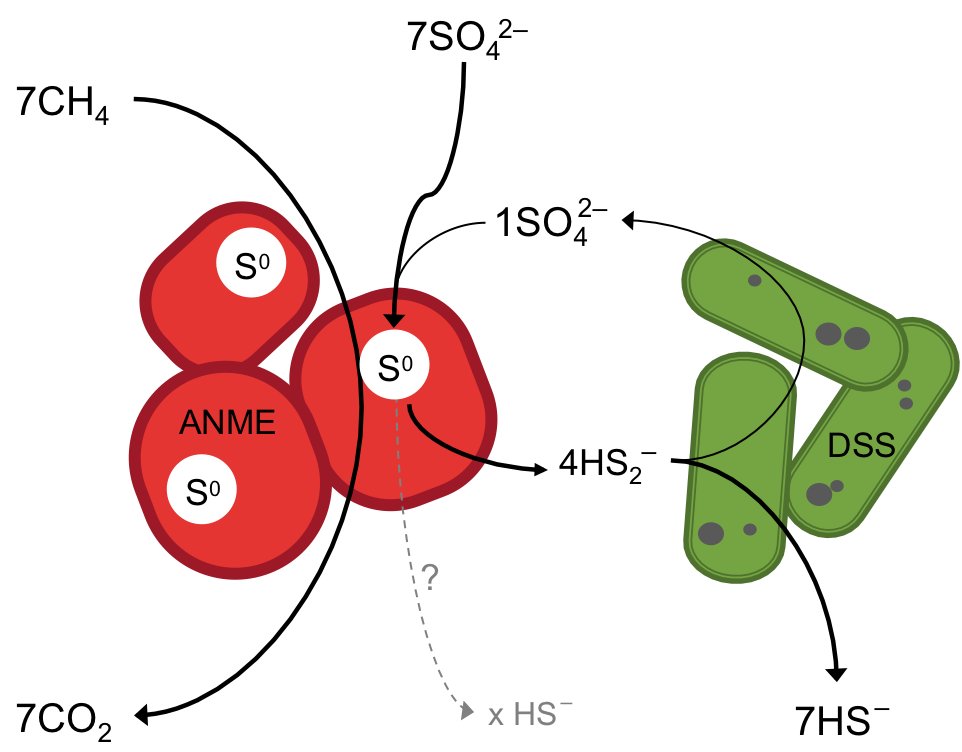
Dieses Schema zeigt, wie die methanabbauenden Archaeen (ANME) das Methan verwerten und dabei das Sulfat zu elementarem Schwefel und möglicherweise zu Sulfid umsetzen. Die mit ihnen zusammenlebenden Bakterien (DSS), disproportionieren den Schwefel (Schwefelfermentation). Sie nehmen den produzierten elementaren Schwefel in Form von Disulfid auf und vergären ihn zu Sulfat und Sulfid. Die dunklen Flecken sind in den Bakterien gefundene eisen- und phosphorreiche Ablagerungen. (Quelle: Jana Milucka)
Die Grundlage für diese gedankliche Kehrtwende ist die Beobachtung, dass elementarer Schwefel gebildet wird, den die methanabbauenden Archaeen speichern. „Mit chromatographischen und modernsten spektroskopischen Methoden haben wir erstaunlich hohe Konzentrationen an elementarem Schwefel in unseren Kulturen gefunden“, sagt Professor Marcel Kuypers und fügt hinzu: „Die Untersuchungen, die wir mit unseren Technologien an einzelnen Zellen durchführen können, haben gezeigt, dass der Schwefelgehalt in den Zellen der methanabbauenden Archaeen viel höher ist als in denen der Bakterienzellen. Unsere Experimente zeigen auch, dass die Archaeen diesen Schwefel durch Sulfatveratmung bilden.“
Welche Rolle spielen dann die Bakterien, wenn die Archaeen sowohl die Sulfatveratmung als auch den Methanabbau übernehmen? „Die Bakterien leben vom elementaren Schwefel, den die Archaeen bilden“, erklärt Jana Milucka, die Erstautorin der Studie. „Sie gewinnen nämlich ihre Energie dadurch, dass sie einen Teil des Schwefels zu Sulfat und den anderen zu Sulfid umsetzen. Das ist eine Form mikrobieller Gärung, ähnlich der alkoholischen Gärung.“
„Bisher hatten wir keine wirklich gute Erklärung für das Vorkommen von elementarem Schwefel in sauerstofffreien Sedimenten“, stellt Timothy Ferdelman, Wissenschaftler am Max-Planck-Institut in Bremen und Koautor der Veröffentlichung, fest. „Unsere Entdeckung liefert also nicht nur einen neuen Mechanismus für die Methanoxidation, sondern lässt auch den Kohlenstoff- und den Schwefelkreislauf im methanreichen Meeressediment in einem neuen Licht erscheinen.“
Welche Rolle spielen dann die Bakterien, wenn die Archaeen sowohl die Sulfatveratmung als auch den Methanabbau übernehmen? „Die Bakterien leben vom elementaren Schwefel, den die Archaeen bilden“, erklärt Jana Milucka, die Erstautorin der Studie. „Sie gewinnen nämlich ihre Energie dadurch, dass sie einen Teil des Schwefels zu Sulfat und den anderen zu Sulfid umsetzen. Das ist eine Form mikrobieller Gärung, ähnlich der alkoholischen Gärung.“
„Bisher hatten wir keine wirklich gute Erklärung für das Vorkommen von elementarem Schwefel in sauerstofffreien Sedimenten“, stellt Timothy Ferdelman, Wissenschaftler am Max-Planck-Institut in Bremen und Koautor der Veröffentlichung, fest. „Unsere Entdeckung liefert also nicht nur einen neuen Mechanismus für die Methanoxidation, sondern lässt auch den Kohlenstoff- und den Schwefelkreislauf im methanreichen Meeressediment in einem neuen Licht erscheinen.“
Ein Teil der Analysen und deren Auswertung fand am NanoSIMS-Spektrometer am Max-Planck-Institut in Bremen statt. Das NanoSIMS ermöglicht es den Wissenschaftlern, die Element- und Isotopenzusammensetzung einzelner mikrobieller Zellen zu messen und zwar mit einer Auflösung von unter einem Mikrometer. Einzelzellanalysen mit NanoSIMS, Raman-Mikrospektroskopie (an der Universität Wien) und Röntgenspektroskopie (Max-Planck-Institut für Polymerforschung, Mainz) haben den entscheidenden Nachweis zur Physiologie der AOM-Mikroorganismen geliefert. (Photo: Jana Milucka)
Weitere Informationen:
Dr. Jana Milucka, +49 421 2028634, [Bitte aktivieren Sie Javascript]
Prof. Dr. Marcel Kuypers +49 421 2028602, [Bitte aktivieren Sie Javascript]
Pressesprecher
Dr. Rita Dunker, +49 421 2028856, [Bitte aktivieren Sie Javascript]
Dr. Manfred Schloesser, +49 421 2028704, [Bitte aktivieren Sie Javascript]
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Alfred-Wegener-Institut für Polar- und Meeresforschung, Bremerhaven
Universität Wien, Wien, Österreich
Max-Planck-Institut für Polymerforschung, Mainz
Originalartikel
Zerovalent sulfur is a key intermediate in marine methane oxidation. Jana Milucka, Timothy G. Ferdelman, Lubos Polerecky, Daniela Franzke, Gunter Wegener, Markus Schmid, Ingo Lieberwirth, Michael Wagner, Friedrich Widdel, Marcel M. M. Kuypers. Nature, 2012.
Doi: 10.1038/nature11656
Dr. Jana Milucka, +49 421 2028634, [Bitte aktivieren Sie Javascript]
Prof. Dr. Marcel Kuypers +49 421 2028602, [Bitte aktivieren Sie Javascript]
Pressesprecher
Dr. Rita Dunker, +49 421 2028856, [Bitte aktivieren Sie Javascript]
Dr. Manfred Schloesser, +49 421 2028704, [Bitte aktivieren Sie Javascript]
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Alfred-Wegener-Institut für Polar- und Meeresforschung, Bremerhaven
Universität Wien, Wien, Österreich
Max-Planck-Institut für Polymerforschung, Mainz
Originalartikel
Zerovalent sulfur is a key intermediate in marine methane oxidation. Jana Milucka, Timothy G. Ferdelman, Lubos Polerecky, Daniela Franzke, Gunter Wegener, Markus Schmid, Ingo Lieberwirth, Michael Wagner, Friedrich Widdel, Marcel M. M. Kuypers. Nature, 2012.
Doi: 10.1038/nature11656