- Presse
- Highlights 2000 - 2011
- Ungewöhnliche Symbiose zwischen Bakterien und marinen Würmern entdeckt (2001)
Ungewöhnliche Symbiose zwischen Bakterien und marinen Würmern entdeckt (2001)
In einer Symbiose gibt es meist zwei Partner, Wirt und Symbiont, die wechselseitig voneinander profitieren. Bislang glaubte man, dass Symbiosen mit mehr als zwei Partnern für den Wirt nachteilig wären. "Konkurrenzkämpfe" um Raum und Nahrung würden zu Lasten des Wirts gehen.
Die Forscherin Dr. Nicole Dubilier aus der Arbeitsgruppe "Molekulare Ökologie" von Privatdozent Dr. Rudolf Amann am Bremer Max-Planck-Institut (MPI) für marine Mikrobiologie und ihre Kollegen berichten jetzt über einen Fall von Symbiose (Nature, 17. Mai 2001), in dem zwei verschiedene Symbionten nicht nur in Frieden in einem Wirt logieren, sondern alle drei Partner auch noch voneinander profitieren.
Diese harmonische "Ménage à trois" wurde in einem in Küstensedimenten vor der Insel Elba lebenden Wurm entdeckt. Dieser marine Vetter des Regenwurmes besitzt weder Mund noch Darm und beherbergt als primären Symbiose-Partner ein Schwefelbakterium, das Energie aus der Oxidation von Schwefelwasserstoff gewinnt. Da Schwefelwasserstoff nicht in ausreichender Konzentration innerhalb seines Lebensraums vorkommt, hat sich der Wurm - als Zweitpartner - eine eigene Schwefelwasserstoffquelle "ins Haus geholt" ? ein sulfatreduzierendes Bakterium, das Schwefelwasserstoff produziert. In ihrem internen Schwefelzyklus tauschen beide Bakterienarten ihre Stoffwechselprodukte untereinander aus und tragen damit gleichzeitig zur Ernährung ihres Wirts bei. Den Bremer Wissenschaftlern gelang es mit modernen molekulargenetischen und biochemischen Methoden, nachzuweisen, wie diese Symbiose im Einzelnen funktioniert (Dubilier, N, Mülders, C, Ferdelman, T, de Beer, D, Pernthaler, A, Klein, M, Wagner, M, Erséus, C, Thiermann, F, Krieger, J, Giere, O, and Amann, R. 2001. Endosymbiotic sulphate-reducing and sulphide-oxidizing bacteria in an oligochaete worm. Nature 411:298-302).
Ohne Symbiosen hätte sich das Leben auf der Erde nicht entwickeln können. Symbiosen zwischen Bakterien und primitiven Einzellern waren entscheidend für die Ausbreitung und Evolution von vielzelligen eukaryontischen Organismen. Noch heute beherbergt jede menschliche Zelle mit den Mitochondrien die Nachfahren früherer bakterieller Symbionten. Ohne Mitochondrien könnte der Mensch nicht atmen. Auch in der jüngeren Evolutionsgeschichte entstanden zahlreiche Partnerschaften zwischen Bakterien und Eukaryonten; so gibt es heute kaum eine Pflanzen- oder Tiergruppe, die nicht von bakteriellen Symbionten profitiert. Diese ungeheure Vielfalt von bakteriellen Symbiosen im Pflanzen- und Tierreich entdeckte man erst vor etwa zehn Jahren mit der Einführung kultivierungsunabhängiger molekularbiologischer Methoden in der Mikrobiologie. Da sich die meisten symbiontischen Bakterien nicht kultivieren lassen, wusste man zuvor wenig über ihre Identität und Funktion. Forschern des Bremer Max-Planck-Instituts für marine Mikrobiologie und ihren Kollegen ist es mit Hilfe molekularbiologischer und biogeochemischer Methoden gelungen, eine ungewöhnliche Symbiose in einem marinen Wurm zu entdecken und damit ein weiteres Beispiel der vielfältigen Spielarten der symbiontischen Diversität aufzuzeigen.
Seit mehreren Jahren arbeitet Dr. Dubilier in einem gemeinsamen Projekt mit Dr. Olav Giere (Universität Hamburg) und Dr. Christer Erséus (Naturhistorisches Museum Schweden) an den Symbiosen in oligochaeten Würmern. Diese marinen Vettern der Regenwürmer besitzen weder einen Mund noch einen Darm und sind für ihre Ernährung auf ihre Symbionten angewiesen. Alle darmlose Oligochaeten beherbergen in ihrem Inneren sulfidoxidierende Mikroorganismen als primäre Symbionten und wurden bislang nur in schwefelwasserstoffhaltigen Meeresböden gefunden. In marinen Sedimenten entsteht Sulfid (= Schwefelwasserstoff) hauptsächlich durch die Aktivität von sulfatreduzierenden Bakterien. Diese Bakterien benutzen organische Kohlenstoffverbindungen als Energiequelle und Sulfat als Oxidationsmittel (Elektronenakzeptor), das dabei zu Sulfid reduziert wird.
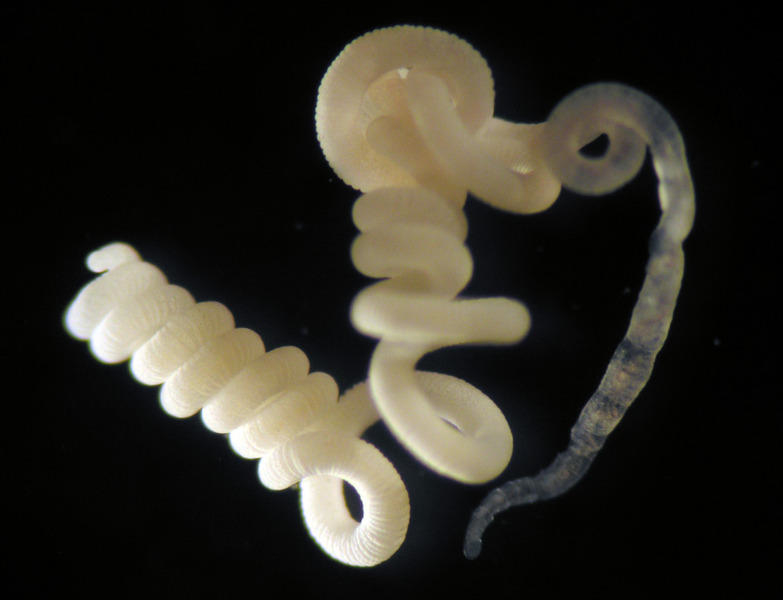
Die Würmer sind sehr dünn (0,2 mm Durchmesser),
m Verhältnis dazu aber sehr lang (1 - 2 cm).
ie Tiere sind weiss gefärbt durch Schwefelkügelchen,
die in den symbiontischen Bakterien sitzen (© Max-Planck-Institut für Marine Mikrobiologie Bremen)
Eine unabdingbare Voraussetzung für alle chemosynthetischen Symbiosen ist, dass reduzierte Schwefelverbindungen wie Sulfid in der Umgebung der Tiere vorhanden sind, denn ohne diese Energiequelle können die Bakterien ihre Wirte nicht versorgen und diese würden verhungern. Deswegen waren Dr. Dubilier und ihre Kollegen sehr überrascht, als sie einen oligochaeten Wurm mit chemosynthetischen Symbionten entdeckten, in dessen Umgebung zunächst kein Schwefelwasserstoff nachgewiesen werden konnte. Der Wurm, mit dem lateinischem Namen Olavius algarvensis wurde im Mittelmeer vor der Küste Elbas (Italien) in einer Badebucht entdeckt (Abb. 1 und 2). Die Würmer leben in der Nähe von Seegrasfeldern in groben Sänden in einer Wassertiefe von 8 - 10 Meter und einer Sedimenttiefe von 5 -15 cm. Direkt unter der Haut dieser Würmer entdeckten die Wissenschaftler neben den bereits bekannten primären sulfidoxidierenden Symbionten, neuartige Sulfid produzierende Bakterien als sekundäre Symbionten. Dies brachte die Forscher sofort auf eine Idee, wie die Würmer in Abwesenheit von Sulfid in ihrer Umgebung überleben könnten: die sekundären Symbionten produzieren Sulfid und versorgen dadurch die primären Symbionten mit der nötigen Energiequelle um Kohlenstoff zu fixieren. Der Nachweis, dass die Symbiose wirklich so funktioniert, gelang mit Hilfe einer ganzen Palette von modernen molekulargenetischen und biogeochemischen Methoden in einer intensiven interdisziplinären Zusammenarbeit mit Kollegen am Bremer Max-Planck-Institut für marine Mikrobiologie und anderer Institute.
fanden Dr. Dubilier und ihre Kollegen diesen
ungewöhnlichen Wurm in 8 Meter Wassertiefe.
Die nahe Verwandtschaft der sekundären Symbionten zu bekannten freilebenden sulfatreduzierenden Bakterien war ein Indiz für die Wissenschaftler, dass es sich bei den Symbionten ebenfalls um Sulfatreduzierer, das heisst Schwefelwasserstoff produzierende Bakterien handelt. Allerdings ist eine enge Verwandschaft zwischen Bakterien noch lange kein Nachweis dafür, dass diese den gleichen Stoffwechsel besitzen. Man weiss inzwischen, dass Bakterien in ihrem Stoffwechsel sehr flexibel sein können und, dass selbst sehr nah verwandte Bakterien völlig unterschiedliche Stoffwechselwege haben können. Die Wissenschaftler mussten also sehr sorgfältig prüfen, ob die vermeintlichen Sulfatreduzierer, auch wirklich solche waren, nicht zuletzt auch, weil die Entdeckung eines sulfatreduzierenden Symbionten zunächst mit Skepsis betrachtet wurde. Es gibt bislang keine bekannten Endosymbiosen zwischen sulfatreduzierenden Bakterien und marinen Wirbellosen, vermutlich weil das von den Bakterien produzierte Sulfid für die meisten Tiere giftig ist. Hinzukommt, dass die meisten Sulfatreduzierer heterotroph (Ernährung durch organische Stoffe) sind, und es ist zunächst unverständlich, welchen Vorteil Tiere, die ebenfalls heterotroph sind, von einer Symbiose mit einem weiteren heterotrophen Organismus hätten. Als Dr. Dubilier und Frau Mülders, in Zusammenarbeit mit Dr. Michael Wagner und Dipl. Biol. Michael Klein (beide Technische Universität München) im Bakteriengenom ein notwendiges Schlüsselgen für die Sulfatreduktion entdeckten, hatten sie nun den Beweis, dass der zweite Symbiont tatsächlich ein Sulfatreduzierer ist. Aber war dieser Sulfatreduzierer auch wirklich aktiv im Wurm? Produzierte er im Wirt Schwefelwasserstoff?
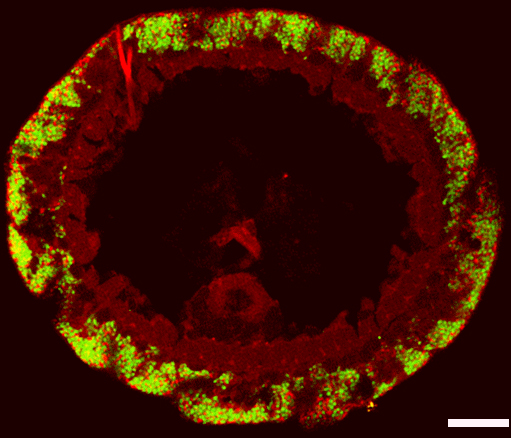
Fluoreszenz-Mikroskop. Die Symbionten sind mit
speziellen Gensonden farbig markiert. Die rote Farbe
zeigt den Sulfatreduzierer, die grüne die Schwefelbakterium
an. Der Maßstab wird durch den Balken, der 0,02 Millimetern
entspricht, angegeben. (Copyright NATURE)
Nun gab es noch eine weitere Frage, die geklärt werden musste: wie wichtig war das von den sulfatreduzierenden Symbionten produzierte Sulfid für die Symbiose? Zwar konnten die Forscher bei ihren ersten Versuchen kein Sulfid in der Umgebung der Würmer messen, aber sie fragten sich, ob die Messmethode, die sie verwendeten, empfindlich genug war. Denn es ist bekannt, dass Bakterien auch bei sehr geringen Sulfidmengen in ihrer Umgebung noch genügend Energie gewinnen können. Es war also durchaus möglich, dass die sulfidoxidierenden Symbionten gar nicht auf das intern produzierte Sulfid von den sulfatreduzierenden Symbionten angewiesen waren. Deshalb entwickelten die Wissenschaftler eine sehr empfindliche Methode um Sulfid in der Umgebung der Würmer zu messen und stellten fest, dass nur winzige Mengen an Sulfid im Sediment vorkamen, vergleichbar mit Konzentrationen in offenen Meeresgewässern, die als sulfidfrei gelten. Der Vergleich von Sulfidflux aus der Umgebung (das heisst die Menge an Sulfid, die in die Würmer pro Zeiteinheit diffundierte) mit der internen Sulfidproduktion der sulfatreduzierenden Symbionten zeigte, dass das intern produzierte Sulfid in der Regel mindestens sieben mal und häufig sogar bis zu 30 mal höher als der Sulfidflux aus der Umgebung war. Damit war es eindeutig, dass die sulfatreduzierenden Symbionten die Hauptquelle für Sulfid in dieser Symbiose sind.
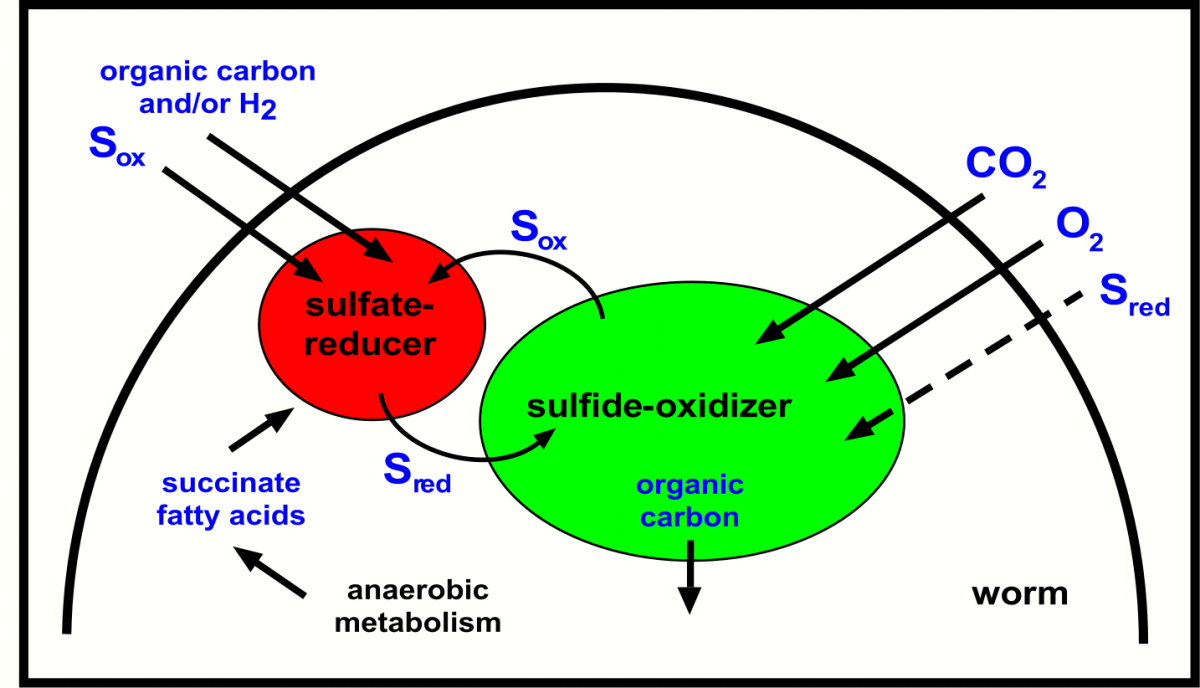
Wie könnte diese ungewöhnliche Symbiose im Einzelnen funktionieren (Abb. 4)? Die sulfatreduzierenden Symbionten produzieren Schwefelwasserstoff, der von den eng benachbarten sulfidoxidierenden Symbionten aufgenommen wird. Diese verwandeln den Schwefelwasserstoff in oxidierte Schwefelverbindungen wie zum Beispiel Sulfat. Diese oxidierten Schwefelverbindungen werden wiederum von den sulfatreduzierenden Symbionten aufgenommen, und in reduzierte Schwefelverbindungen wie zum Beispiel Sulfid umgewandelt. So entsteht ein zyklischer oder syntropher Schwefelkreislauf, der auf den ersten Blick wie ein "Perpetuum mobile" wirkt. Tatsächlich müssen aber Energiequellen von außen aufgenommen werden, damit der Wurm wachsen kann. Hierzu gehören zum Beispiel organische Kohlenstoffverbindungen, die in den Porenwässern des Meeresboden in löslicher Form vorkommen und von den sulfatreduzierenden Bakterien genutzt werden können.
Der Sulfidoxidierer fixiert CO2 in organische Verbindungen und gibt diese
an den Wirt weiter. Abfallprodukte vom Wirt (anaerobe Stoffwechselprodukte
wie Succinat) können in einer Art symbiontischen Recyclings vom
Sulfatreduzierer wiederverwertet werden. Dieses scheinbare "Perpetuum mobile" ist keins: Energiequellen wie organische Kohlenstoffverbindungen müssen aus der Umgebung aufgenommen werden, damit der Wurm wachsen kann. Sollte der Sulfatreduzierer autotroph sein, also Kohlenstoff aus CO2 gewinnen, dann könnte auch Wasserstoff als Energiequelle dienen . (Copyright NATURE)
Was hat der Wurm von diesem Arrangement? Der zyklische Austausch von Stoffwechselprodukten zwischen den beiden Symbionten führt dazu, dass diese mehr Energie produzieren als ohne den Partner. Diese zusätzliche Energie könnte wiederum dem Wirt zu Gute kommen. Ein weiterer Vorteil für den Wurm ist, dass der Sulfatreduzierer ihm lästige Stoffwechselprodukte abnehmen könnte, die er sonst ausscheiden müsste. Diese Abfallprodukte, genannt anaerobe Stoffwechselprodukte (wie zum Beispiel Succinat), produzieren marine Tiere sobald Sauerstoff nicht mehr in ausreichender Menge in ihrer Umgebung vorkommt. Wenn der Wurm diese anaeroben Stoffwechselprodukte intern durch "symbiontisches Recycling" wieder verwerten kann statt sie auszuscheiden, spart er erheblich Energie. Die Symbiose mit einem Sulfatreduzierer hat noch einen Vorteil: Dank dieser sekundären Symbionten haben die Würmer und ihre primären sulfidoxidierenden Symbionten stets eine innere Schwefelwasserstoffquelle bei sich. So konnte die Aufnahme eines Sulfatreduzierers als Symbionten den Würmern die Besiedlung neuer Habitate ohne hohe Sulfidvorkommen ermöglichen und ihnen damit eine Ausbreitung ihres Lebensraumes ermöglichen.
Rückfragen bitte an:
Direktorin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
3241 |
|
Telefon: |

Pressereferentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |