- Presse
- Pressemeldungen 2020
- Wasser am Ende des Tunnels
Wasser am Ende des Tunnels
Methan ist ein starkes Treibhausgas, das eine zentrale Rolle im globalen Kohlenstoffkreislauf spielt. Gleichzeitig dient es als wichtige Energiequelle für uns Menschen. Rund die Hälfte des jährlich produzierten Methans entsteht durch Mikroorganismen, die als Methanogene bezeichnet werden. Das Gas entsteht vor allem dann, wenn die Methanogenen organisches Material, wie Pflanzenreste, zersetzen. Das geschieht normalerweise in sauerstofffreien Umgebungen, da Sauerstoff wie ein starkes Gift auf Methanbakterien wirkt und sie tötet. Doch auch in eigentlich sauerstofffreien Lebensräumen tauchen gelegentlich Sauerstoffmoleküle auf. Um diese Eindringlinge unschädlich zu machen, besitzen Methanogene ein besonderes Enzym, das den Sauerstoff in Wasser verwandeln kann.
„Enzyme sind lebenswichtige Bestandteile des Stoffwechsels aller lebenden Organismen. Das Ziel unserer Forschung ist zu verstehen, wie diese Nano-Maschinen auf molekularem Level funktionieren“, sagt Tristan Wagner, Leiter der Forschungsgruppe Mikrobielle Metabolismen am Max-Planck-Institut für Marine Mikrobiologie und einer der beiden Erstautoren der Studie, die jetzt in dem wissenschaftlichen Fachmagazin Chemical Communication erschienen ist. Wagner hat für die Studie die anaeroben Mikroorganismen Methanothermococcus thermolithotrophicus kultiviert, die aus dem Meeresboden des Golfs von Neapel stammen. Er isolierte das Enzym F420-Oxidase (ein Flavodiiron-Protein) und kristallisierte es – eine gängige Methode, um die Funktionsweise von Enzymen zu untersuchen.
„Es war bereits bekannt, dass F420-Oxidase Sauerstoff in Wasser umwandeln kann“, sagt Wagner. „Aber uns ist es gelungen, den Mechanismus zu entschlüsseln.“ Für die Studie arbeiteten Wissenschaftlerinnen und Wissenschaftler des Max-Planck-Instituts für Marine Mikrobiologie, des Max-Planck-Instituts für Terrestrische Mikrobiologie, des Paul Scherrer Instituts, des Interdisciplinary Research Institute of Grenoble und des European Synchrotron Radiation Facility zusammen.
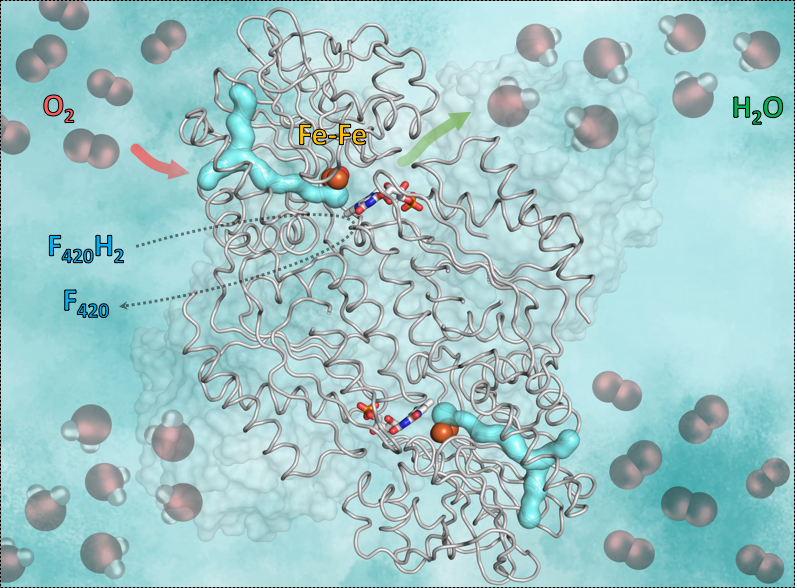
Sauerstoff wird eingesperrt
Der Mechanismus, den die Forschenden entdeckten, hat eine wichtige Voraussetzung: Sauerstoff ist ein sehr reaktionsfreudiges Molekül, deshalb ist es zentral, dass das Enzym die Reaktion genau kontrolliert. So darf zum Beispiel kein Wasser zugegen sein, durch das der Sauerstoff „versehentlich“ in Superoxid umgewandelt wird und die anaerobe Mikrobe tötet. Der Trick, den das Enzym F420-Oxidase dafür verwendet, ist eine Kombination aus einem Gas-Kanal und einer Tür. Um die Sauerstoff-Moleküle unschädlich zu machen, nutzt das Enzym den Gas-Kanal, durch den es den Sauerstoff in einen wasserfreien Hohlraum führt. Der Sauerstoff wird in diesem Hohlraum eingesperrt, der zwar kein Wasser, aber dafür Eisen enthält. Das Eisen wirkt als Katalysator und wandelt den Sauerstoff zu Wasser um. Die dafür notwendigen Wasserstoff-Moleküle liefert das Koenzym F420. Anschließend beginnt der Hohlraum, sich zu bewegen und öffnet eine kleine „Tür“. Dank der Bewegung des Raumes wird das Wasser durch diese Öffnung nach draußen befördert. Der Hohlraum schließt sich wieder und steht für das nächste Sauerstoff-Molekül zur Verfügung.
Um diesen Mechanismus zu untersuchen, nutzten die Forschenden Röntgenkristallografie. Dabei erhielten sie zunächst die Kristallstruktur des Enzyms ohne Sauerstoff und konnten den wasserfreien katalytischen Hohlraum sehen. Dann begasten sie die Enzymkristalle zuerst mit dem Edelgas Krypton, das im Gegensatz zu Sauerstoff durch Röntgenstrahlen sichtbar gemacht werden kann. Anschließend röntgten sie die Kristalle und konnten Krypton-Atome nachweisen, die den zur katalytischen Höhle führenden Gas-Kanal zeigten. Das Flavodiiron-Protein und seine Gas-Kanäle wurden nicht nur in Methanogenen nachgewiesen, sondern auch in anderen Mikroorganismen, wie Clostridien (kommen vor allem in Böden und im Verdauungstrakt vor), in Schwefelbakterien, wie Desulfovibrio gigas oder sogar in dem Darm-Parasiten Giardia intestinalis.
Je schneller desto besser
„Diese Reaktion läuft sehr schnell ab“, sagt Sylvain Engilberge vom Paul Scherrer Institut, neben Wagner Erstautor der Studie. „In der Geschwindigkeit liegt auch die große Bedeutung unserer Ergebnisse.“ Ähnliche Enzyme, wie Laccase, sind viel langsamer. „Für die künftige Anwendung bio-inspirierter elektrochemischer Prozesse ist es wichtig, dass wir mehr über die chemische Reaktion, Struktur und Funktion der verschiedenen Gruppen von Sauerstoff-reduzierenden Enzymen lernen“, sagt Engilberge. Dies könne zum Beispiel den Weg für ein Protein-Engineering ebnen, um schnelle Sauerstoff-Entgifter für industrielle Prozesse zu nutzen.
„Der nächste Schritt ist nun, die Diversität des Flavodiiron-Proteins zu verstehen“, sagt Tristan Wagner. So zielen einige baugleiche Bakterien nicht auf Sauerstoff, sondern auf das giftige Stickstoffmonoxid ab, wobei das Enzym beide Gase exakt unterscheiden kann. Aber was ist der entscheidende Filter - der Gas-Kanal? Oder die Umweltbedingungen im Hohlraum? „Es müssen noch mehr Untersuchungen gemacht werden, um zu verstehen, wie das Protein Sauerstoff und Stickstoffmonoxid unterscheiden kann“, erläutert Wagner. Mit diesem Wissen wird es dann möglich sein, aus der genetischen Information herauszulesen, ob ein Flavodiiron-Protein ein Sauerstoff-Fänger oder ein Stickstoffmonoxid-Fänger ist.
Originalveröffentlichung
Sylvain Engilberge#, Tristan Wagner#, Philippe Carpentier, Eric Girard, Seigo Shima: Krypton-derivatization highlights O2-channeling in a four-electron reducing oxidase. Chemical Communication, September 2020
DOI: 10.1039/d0cc04557h
# Die beiden Autoren haben gleichberechtigt zum Paper beigetragen
Beteiligte Institute
- Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
- Max-Planck-Institut für Terrestrische Mikrobiologie, Marburg, Deutschland
- Paul Scherrer Institut (PSI), Villigen, Schweiz
- Interdisciplinary Research Institute of Grenoble, Frankreich
- European Synchrotron Radiation Facility, Grenoble, Frankreich
Rückfragen bitte an:
Gruppenleiter
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen

