- Presse
- Pressemeldungen 2021
- Neue Form der Symbiose entdeckt
Neue Form der Symbiose entdeckt
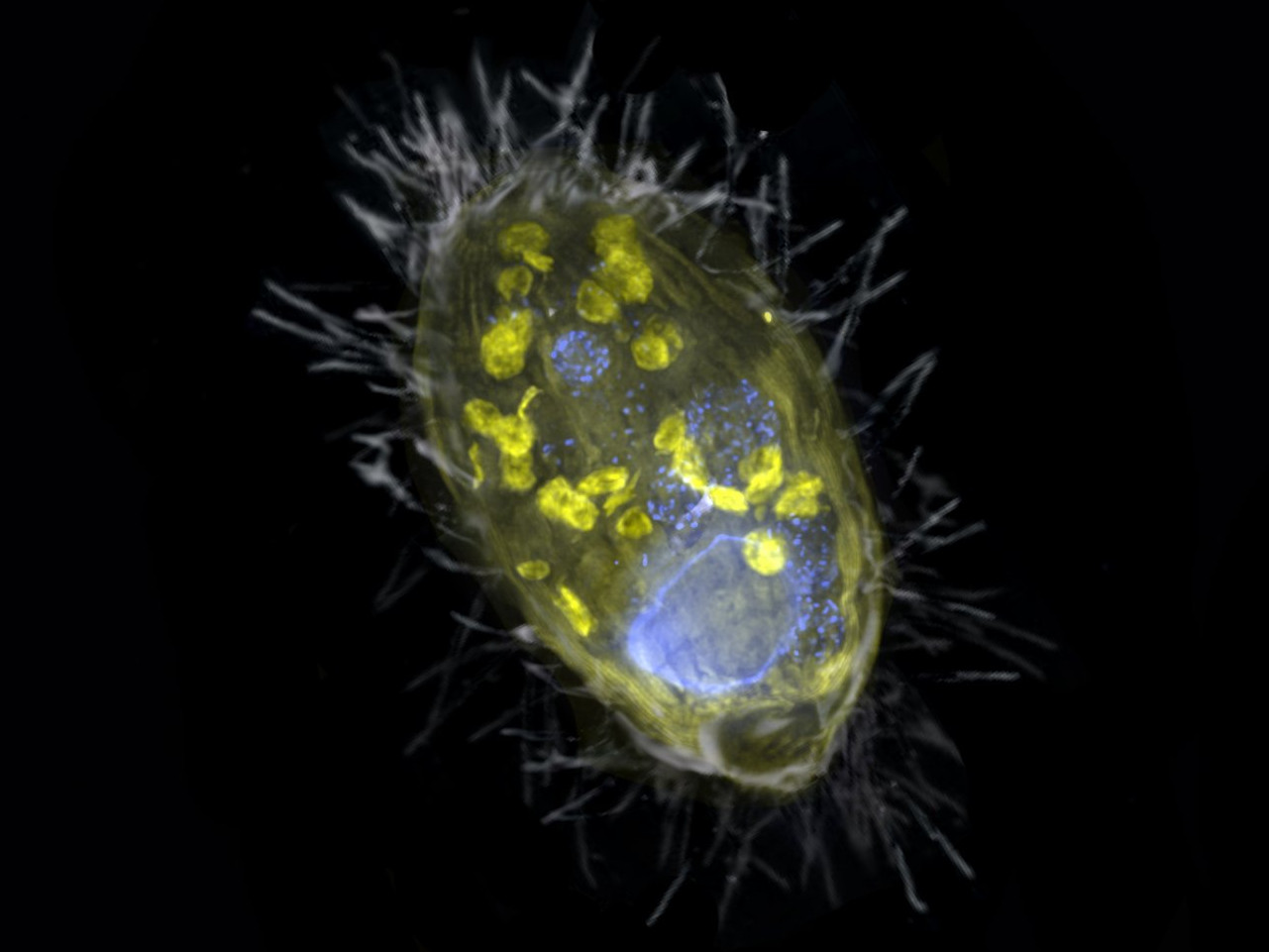
Die Bremer Forschenden haben in einem einzelligen Wimpertierchen aus dem Zugersee in der Schweiz ein Bakterium gefunden, dessen Aufgabe es ist, für das Wimpertierchen zu atmen und es mit Energie zu versorgen. Wobei dieser so genannte Endosymbiont nicht Sauerstoff nutzt, sondern Nitrat. „Eine solche Lebensgemeinschaft ist völlig neu“, sagt Jana Milucka, Leiterin der Gruppe Treibhausgase am Max-Planck-Institut für Marine Mikrobiologie und eine der Hauptautorinnen des Nature-Papers. „Der Endosymbiont und sein Wirt stellen ein noch nie dagewesenes Beispiel für eine Symbiose dar, die auf dem direkten Transfer von Energie und nicht auf Ernährung basiert.“
Eine Endosymbiose ist an sich nichts Ungewöhnliches. Es handelt sich dabei um eine Lebensgemeinschaft zwischen einem Wirt und einem weiteren Organismus, wie einem Bakterium. Dieses lebt in dem Wirt und erledigt für ihn gewisse Dienste, bereitet beispielsweise seine Nahrung zu oder versorgt ihn mit essenziellen Vitaminen. Der Wirt bietet im Gegenzug geeignete Lebensbedingungen für den Symbionten. Eine Endosymbiose kann sogar so weit gehen, dass das Bakterium im Wirt nicht mehr benötigte Eigenschaften nicht mehr ausbildet und außerhalb des Wirts gar nicht mehr überleben kann.
Die Endosymbiose, die der Wissenschaftler Jon Graf vom Max-Planck-Institut für Marine Mikrobiologie mit der Unterstützung von Kolleginnen und Kollegen seines Instituts sowie des Max-Planck- Genom-Zentrums in Köln und dem Wasserforschungsinstitut Eawag aus der Schweiz entdeckt hat, wirft ein vollkommen neues Licht auf die Art und Weise, wie Eukaryoten – so die fachliche Bezeichnung von Lebewesen mit Zellkern – in sauerstofffreier Umwelt leben. „Unsere Entdeckung zeigt die Möglichkeit, dass einzellige Eukaryoten energieliefernde Endosymbionten haben können, um die Funktionen ihrer Mitochondrien zu ergänzen oder zu ersetzen“, sagt Jon Graf, Erstautor der Nature-Studie. „So kann der Endosymbiont, den wir ‚Candidatus Azoamicus ciliaticola‘ genannt haben, die Stickstoffverbindung Nitrat atmen und zur Energieproduktion verwenden.“ Der Name „Azoamicus“ bedeutet sinngemäß genau dies: Freundschaft, die auf Stickstoff basiert.
Eine innige Partnerschaft wird immer enger
Bisher war man davon ausgegangen, dass Eukaryoten in sauerstofffreien Umgebungen ihre Energie über Fermentation gewinnen, da Mitochondrien Sauerstoff benötigen, um Energie liefern zu können. Dieser Prozess ist gut dokumentiert und ist bei vielen anaeroben Wimpertierchen beobachtet. Allerdings ist Fermentation energetisch ungünstig. Die Mikroorganismen ziehen aus ihr nicht viel Energie und sind deshalb oft langsam und brauchen lange für Wachstum und Zellteilung.
„Unser Wimpertierchen hat dafür eine Lösung gefunden“, sagt Graf. „Es hat ein Bakterium mit der Fähigkeit zur Nitratatmung aufgenommen und hat es in seinen Organismus integriert. Wir schätzen, dass diese Aufnahme vor mindestens 200 bis 300 Millionen Jahren stattgefunden hat.“ Seitdem sorgt die Evolution für die weitere Vertiefung der innigen Partnerschaft. Zusammen können die Mikroorganismen ohne Sauerstoff gedeihen.
So ähnlich ist auch die Evolution der Mitochondrien verlaufen. „Alle Mitochondrien haben einen gemeinsamen Ursprung“, erläutert Jana Milucka. So habe ein Ur-Archaeon vor mehr als einer Milliarde Jahren ein Bakterium aufgenommen. Die beiden gingen eine für unser Leben sehr bedeutsame Symbiose ein: Es war der Ursprung der eukaryotischen Zellen. Im Verlauf der Evolution wurde das Bakterium immer mehr in die Zelle integriert und reduzierte dabei sein eigenes Genom. Nicht mehr benötigte Eigenschaften wurden abgelegt und nur die Eigenschaft, die dem Wirt nutzt, blieb erhalten. So entwickelten sich die Mitochondrien. Sie verfügen bis heute über ein eigenes kleines Genom sowie über eine Zell-Membran und existieren als so genannte Organellen in Eukaryoten. Im menschlichen Körper beispielsweise sind sie in fast jeder Zelle vorhanden und versorgen sie – und damit uns – mit Energie.
„Unsere Entdeckung zeigt nun, dass prinzipiell auch Endosymbionten mitochondriale Funktionen in Eukaryoten übernehmen können“, sagt Milucka. „Es ist nicht unwahrscheinlich, dass unser Symbiont den gleichen Weg nimmt wie die Mitochondrien und irgendwann zu einer Organelle wird.“
Methanfresser gesucht, Endosymbionten gefunden
Eigentlich erstaunlich, dass das bislang noch niemand entdeckt hatte. Mitochondrien funktionieren mit Sauerstoff so gut, warum sollte es nicht ein Äquivalent für Nitrat geben? Die Antwort liegt wohl darin, dass diese Möglichkeit von niemandem in Betracht gezogen wurde und deshalb bisher keiner danach suchte. Eine solche Symbiose detailliert zu untersuchen, ist nämlich eine besondere Herausforderung, da sich die meisten symbiontischen Mikroorganismen nicht isoliert züchten lassen. Erst metagenomische Analysen haben es möglich gemacht, einen besseren Einblick in das komplexe Zusammenspiel von Wirten und Symbionten zu gewinnen. Bei der Analyse eines Metagenoms schauen sich die Wissenschaftlerinnen und Wissenschaftler die Gesamtheit der Gene in einer Probe an. Bei Umweltproben wird dieses Vorgehen oft angewendet, da sich die Gene in einer Probe nicht automatisch den vorhandenen Organismen zuordnen lassen (siehe Kasten). Das bedeutet, dass Forschende in der Regel nach bestimmten Gensequenzen suchen, die relevant für die eigene Fragestellung sind. Metagenome enthalten oft Millionen von Sequenzen und es ist normal, dass nur einen Bruchteil davon detailliert analysiert wird.
Auch die Bremer Wissenschaftlerinnen und Wissenschaftler suchten ursprünglich etwas anderes. Die Forschungsgruppe Treibhausgase untersucht Methanbakterien und die Stickstoffumsetzung in den tiefen Wasserschichten des Zugersees. Der See ist stark geschichtet, was bedeutet, dass es keinen vertikalen Wasseraustausch gibt. Die tiefen Wasserschichten des Zugersees haben keinen Kontakt zum Oberflächenwasser und sind weitgehend isoliert. Dadurch gibt es dort keinen Sauerstoff, sondern stattdessen Stickstoffverbindungen, wie Nitrat. Graf war auf der Suche nach Methanfressern, die Gene für Stickstoffumsetzung besitzen.
Metagenomanalyse
Das Genom ist die Gesamtheit der Gene in einem Organismus. In der klassischen Genomanalyse sequenziert man die Erbsubstanz einer bestimmten Art mit Hilfe etablierter Methoden, und jedes Jahr publizieren die Wissenschaftler in den Datenbanken hunderte verschiedener Genome. Der klassische Ansatz funktioniert jedoch nicht bei Umweltproben. Etwa in Wasserproben liegt ein Gemisch von verschiedenen Organismen vor, die Zuordnung der Gen-Sequenzen ist nicht klar erkennbar. Bei Umweltproben werden daher metagenomische Analysen verwendet. Der Begriff Metagenom umfasst die Gesamtheit der Genome verschiedener Organismenarten.
Bei metagenomischen Analysen besteht die große Herausforderung, das Gemisch an Genomen aus der Umweltprobe einzelnen Arten zuzuordnen. Dieses Problem lässt sich mit einem Beispiel veranschaulichen: Man stelle sich vor, die Bücher verschiedener Autoren seien hoffnungslos durcheinander geraten. Die Texte liegen nur noch in Bruchstücken vor. Aufgabe ist es nun, die ursprünglichen Werke wiederherzustellen. Da jeder Autor einen anderen Schreibstil bevorzugt, kann man die Ursprungstexte mit Hilfe einer statistischen Analyse der Bruchstücke rekonstruieren. So ähnlich funktioniert die Analyse eines Metagenoms. Mathematische Algorithmen helfen, diese Puzzles zu lösen. Fragmente können zusammengesetzt, gelesen und somit einzelne Genome rekonstruiert werden.
Doch statt auf eine Gensequenz von einem methanfressenden Bakterium stieß Graf auf eine verblüffend kleine Gensequenz, die den kompletten Stoffwechselweg für die Nitratatmung kodierte. „Wir waren sehr überrascht und verglichen diese DNA mit ähnlichen Gensequenzen“, sagt Graf. Doch die Forschenden fanden nur die DNA von Symbionten, die beispielsweise in Blattläusen und anderen Insekten leben und dort zum Beispiel Aminosäuren produzieren. „Das machte für unser Genom aber keinen Sinn. Wie sollten Insekten in die dunklen Tiefen eines Sees kommen? Und warum?“, erinnert sich Graf. In der Forschungsgruppe begannen Ratespiele und Wetten.
Nicht allein im dunklen See

Schließlich blieb die Theorie übrig, dass das Genom wegen seiner kleinen Größe zu einem unbekannten Symbionten gehören muss. Um diese Theorie zu belegen, fuhren die Bremer Wissenschaftlerinnen und Wissenschaftler mehrfach in die Schweiz, um mit Hilfe des Kooperationspartners Eawag gezielt einen Organismus mit diesem Endosymbionten im Zugersee zu suchen. Im Labor fischten sie dann verschiedene Organismen mit einer Pipette aus den Wasserproben. Über einen Genmarker gelang es den Endosymbionten und seinen Wirt zu identifizieren und auch zu visualisieren.
Eine Ausfahrt vor einem Jahr sollte schließlich letzte Gewissheit bringen. Ein schwieriges Unterfangen mitten im Winter auf Gut Glück. Schlechtes Wetter mit Sturm sowie viel Nebel und Zeitdruck durch erste Nachrichten zu Corona sowie einem möglichen Lockdown erschwerten die Suche in dem großen See zusätzlich. Doch es gelang, mehrere Proben aus dem Tiefenwasser zu ziehen, nach Bremen zu bringen und zu analysieren. Mit den Ergebnissen konnten die Wissenschaftlerinnen und Wissenschaftler ihre Theorie erneut belegen. „Es ist irgendwie ein schöner Gedanke: Sie leben zusammen, um nicht allein im dunklen See zu sein“, sagt Jana Milucka. „Normalerweise frisst dieses Wimperntierchen Bakterien. Doch dieser ließ eines am Leben und verband sich mit ihm.“
Viele neue Fragen
An die Entdeckung schließen sich nun viele Fragen an. Gibt es ähnliche Symbiosen, die schon wesentlich länger existieren und bei denen der Endosymbiont schon fast die Grenze zur Organelle überschritten hat? Wenn es eine solche Symbiose für die Nitratatmung gibt, existiert sie vielleicht auch für andere Stoffe, zum Beispiel für Schwefel? Wie kommt ein Mikroorganismus, den es seit 200 bis 300 Millionen Jahren geben muss, in einen See in den Alpen, der erst nach der letzten großen Eiszeit vor rund 10.000 Jahren entstanden ist? Und: „Jetzt, wo wir wissen, was wir suchen, haben wir das Genom in Gensequenzen aus Seen überall auf der Welt entdeckt“, sagt Milucka. In Frankreich genauso wie in Taiwan oder Seen in afrikanischen Ländern, die teilweise sehr viel älter sind. Liegt hier irgendwo der Ursprung dieser Symbiose? Oder liegt sie gar im Ozean? Diese Frage will sich die Forschungsgruppe als nächstes ansehen.
Bericht über die Forschung im Nature-Podcast
Jana Milucka berichtet über die Entdeckung der neuen Symbiose und wie es dazu kam im Nature-Podcast (auf Englisch). Hier ist der Link: https://www.nature.com/nature/podcasts
Originalveröffentlichung
Jon S. Graf, Sina Schorn, Katharina Kitzinger, Soeren Ahmerkamp, Christian Woehle, Bruno Huettel, Carsten J. Schubert, Marcel M. M. Kuypers, Jana Milucka: Anaerobic endosymbiont generates energy for ciliate host by denitrification. Nature, 2021
Beteiligte Institutionen
- Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
- Max-Planck-Genom-Zentrum Köln, Max-Planck-Institut für Pflanzenzüchtungsforschung, Köln, Deutschland
- Eawag Wasserforschungsinstitut, Kastanienbaum, Schweiz
Rückfragen bitte an:
Gruppenleiterin
Forschungsgruppe Treibhausgase
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
Deutschland
|
Raum: |
3128 |
|
Telefon: |

