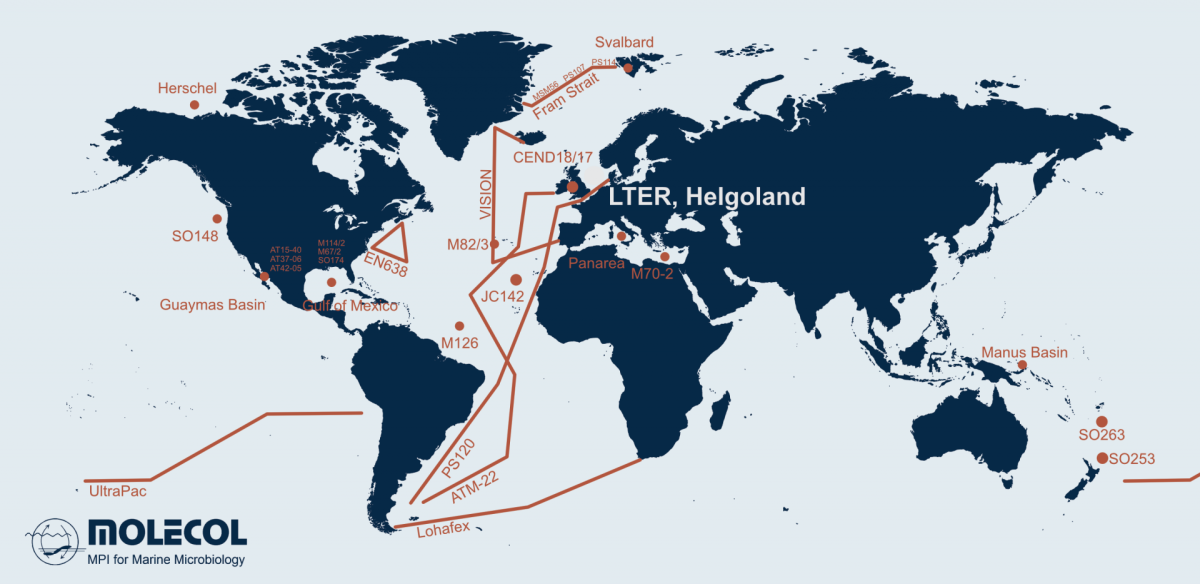
- Molekulare Ökologie
Abteilung Molekulare Ökologie
Gruppen
Projekte
Geschäftsführender Direktor
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2221 |
|
Telefon: |

Assistentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |

"Wir gratulieren Anissa Grieb zur erfolgreichen Verteidigung ihrer Doktorarbeit" [28.06.19]
Inspiration und Fokus unserer Abteilung
Lange bevor sich Pflanzen und Tiere entwickelt hatten, prägten einzellige Mikroorganismen das Gesicht unserer Erde und blieben seitdem essentiell wichtig für die Bewohnbarkeit unseres blauen Planeten. Nukleinsäure-basierte Techniken öffnen heute das Tor zur Entdeckung der vollen Diversität mariner Mikroorganismen. Mit Methoden der Kultivierung wurden bisher einige tausend Arten von Bacteria und Archaea beschrieben, jedoch finden wir die molekularen Fingerabdrücke von Millionen von Mikroorganismen in der Umwelt. Obwohl die Hochdurchsatz-Sequenzierung schnell viele Informationen zum Artenreichtum und zur Artenverteilung liefert, bleibt die Quantifizierung einzelner Spezies in der Umwelt eine Herausforderung. Wir verwenden die Fluoreszenz-in-situ-Hybridisierung für die mikroskopische Identifizierung von einzelnen Zellen und ihre Lokalisierung in der Umwelt. Vergleichende Genomanalysen und das Verfolgen der Aufnahme von Substraten erlauben uns die physiologische Rolle und das biochemische Potential von nicht-kultivierten Bacteria und Archaea abzuleiten. Unser Ziel ist es, über die quantitative Beschreibung von mikrobiellen Gemeinschaften hinaus zu gehen. Wir treffen Voraussagen über die ökologische Nische mariner Mikroorganismen und testen diese Hypothesen in der Umwelt, indem wir taxonomischen Gruppen Funktionen im jeweiligen Habitat zuordnen.
Auch unkultivierte Mikroben brauchen eine eigene Taxonomie
Die Taxonomie umfasst die Identifizierung, Klassifizierung und Nomenklatur von Organismen. Als solche ist die Taxonomie eine Voraussetzung für die Ökologie. Nur auf der Grundlage genauer taxonomischer Konzepte und Methoden kann die Vielfalt und Zusammensetzung komplexer mikrobieller Gemeinschaften genau beschrieben und überwacht werden. Unsere Abteilung blickt auf eine lange Tradition in der Entwicklung und Anwendung neuer taxonomischer Methoden zurück. Dabei haben wir Pionierarbeit bei der in situ Identifizierung, Quantifizierung und Lokalisierung von bislang unkultivierten Bakterien und Archaeen mittels Fluoreszenz-in-situ-Hybridisierung (FISH) mit rRNA-gerichteten Oligonukleotid-Sonden geleistet (Amann et al. 1995; Amann & Fuchs 2008). Dazu zählt auch eine langjährige Zusammenarbeit mit Wolfgang Ludwig und Ralf Westram, den beiden Hauptentwicklern des ARB-Programms. ARB wird weit verbreitet seit mehr als zwei Jahrzehnten sowohl für die Rekonstruktion von 16S rRNA-basierten phylogenetischen Bäumen als auch für die Entwicklung von Oligonukleotid-Sonden verwendet. Hervorgegangen aus ARB ist die viel genutzte, kuratierte 16S rRNA-Datenbank SILVA (Quast et al. 2013; Yilmaz et al. 2014). Das SILVA Datenbank Projekt war für viele Jahre in unserer Abteilung beheimatet und ist kürzlich an die Deutsche Sammlung von Mikroorganismen und zellkulturen (DSMZ) nach Braunschweig übertragen worden.
Die Mehrzahl der Mikroorganismen ist bislang unkultiviert. Daher werden Schwellenwerte benötigt, um zu beurteilen, ob 16S rRNA-Fingerabdrücke aus Umweltproben auf die Existenz neuer Arten, Gattungen, Familien, Ordnungen, Klassen oder sogar neuer Phyla hinweisen. Die Abteilung Molekulare Ökologie hat dazu beigetragen, mittlerweile weit verbreitete Standards der 16S rRNA-basierten Klassifizierung zu erarbeiten (Yarza et al. 2014). Heute ermöglicht die "genomische Revolution" sehr detaillierte Beschreibungen neuer Taxa ohne vorherige Kultivierung. Es ist offensichtlich, dass Ordnung auch in die eher unkontrollierte alphanumerische Benennung von "neu" gebracht werden muss (Konstantinidis et al. 2017). Die Analyse von Einzelzellgenomen bzw. von Genomen, die aus Metagenomen assembliert ("MAG") wurden, offenbart die wahre Vielfalt der Mikroorganismen, die atemberaubend, aber sicher nicht unendlich ist (Amann & Rossello-Mora 2016). Gegenwärtig haben andere Wissenschaftler und wir die dringende Notwendigkeit für eine korrekte Taxonomie der reichlich vorhandenen und funktionell wichtige Taxa von Umweltbakterien und -archaea erkannt. Als funktionell wichtig haben wir kürzlich mehrere neue marine Taxa beschrieben, darunter die Art Candidatus Prosiliicoccus vernus (Francis et al. 2019) und die Gattung Candidatus Abditibacter (Grieb et al. 2020). Da der taxonomische Rang von Candidatus jedoch vorläufig ist und die Nomenklatur keine Priorität hat, sind andere und wir davon überzeugt, dass genomische Information als Materialtyp für die dauerhafte Beschreibung neuer Mikroorganismen akzeptiert werden sollte (Konstantinidis et al. 2020). Ökologen und Taxonomen benötigen einen Fahrplan für die Benennung von unkultivierten Archaeen und Bakterien (Murray et al. 2020), der mit dem aktuellen "Code of Nomenclature" kompatibel ist, der lebende Reinkulturen als Materialtyp verlangt. Wir glauben, dass dadurch die Anreicherungs- und Kultivierungsarbeit von anderen und uns weder behindert noch gebremst werden würde, da sie mehr denn je benötigt wird. Wir wissen jetzt nicht mehr nur über die bloße Anwesenheit von Mikroorganismen in der Umwelt Bescheid, sondern können auch vorhersagen, was sie tun und ihre Ökologie charakterisieren. Währenddessen warten wir auf Erfolge in den Kultivierungsbemühungen, die eine genauere Untersuchung dieser Mikroorganismen ermöglichen werden. Diese "Geister" haben Namen und wir kennen ihre Genome.
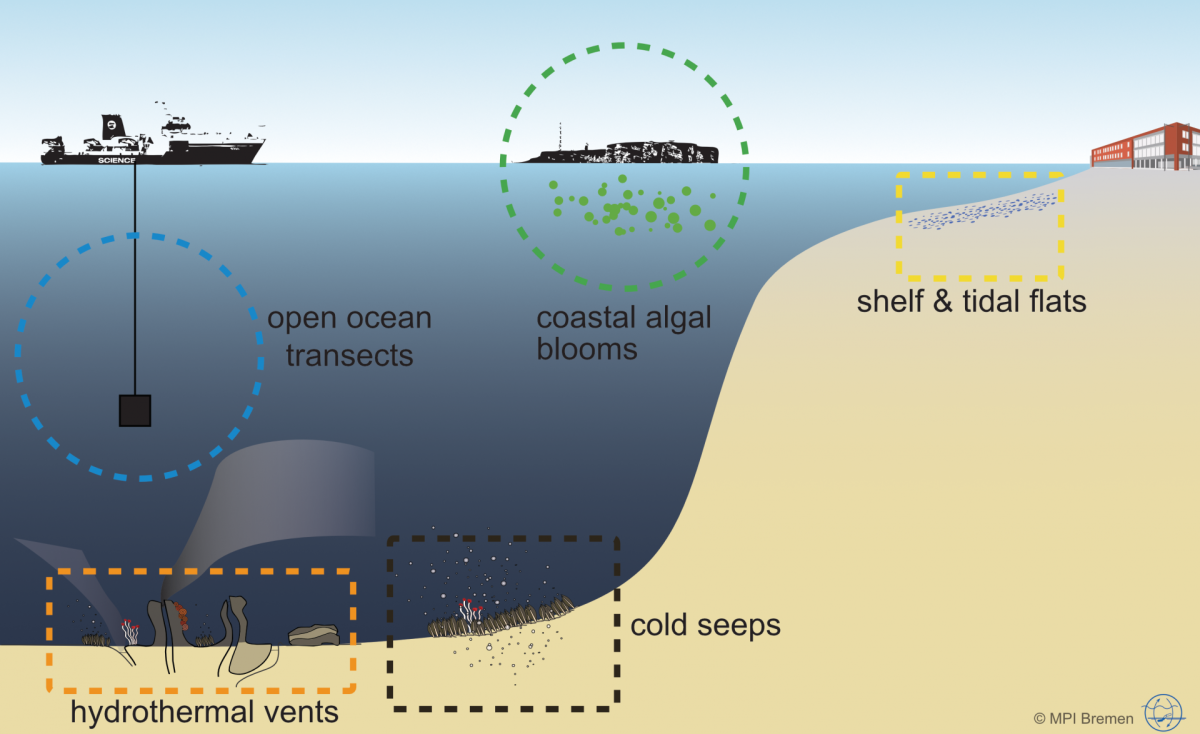
Diveristät, Visualisierung und Kultivierung
Die Isolierung von marinen Mikroorganismen ist eine nicht zu unterschätzende Herausforderung, da es schwierig ist, die natürliche Umgebung und die spezifischen Bedingungen, die für das Wachstum einer Population erforderlich sind, nachzubilden. Dennoch ist die Kultivierung in den meisten Fällen die einzige Möglichkeit, Vorhersagen und Hypothesen, die aus genomischen Sequenzinformationen formuliert wurden, experimentell zu verifizieren. Wir verwenden daher Flüssigmedien und Anreicherungen zusammen mit der physischen Trennung einzelner Zellen durch Verdünnung und molekulare Identifizierungsmethoden (im Haus entwickelte spezifische PCR- und FISH Sonden), um häufig abundante Mikroben aus natürlichen Gemeinschaften zu isolieren. Sobald ein Bakterienstamm in Reinkultur vorliegt, ist die Versorung mit biologischem Material gesichert und es können physiologische Eigenschaften und individuelle Enzyme untersucht werden.
In Kombination mit den Kultivierungsbemühungen verwenden wir eine Vielzahl zusätzlicher Techniken, um die Diversität und Ökologie natürlicher Populationen zu beurteilen. Zu diesen Methoden gehören die Sequenzierung von Umweltpopulationen (Metagenomics und Metatranscriptomics mit Illumina HiSeq und PacBio Sequel II Plattformen), Substratinkubationen und FISH. Durch die Anwendung dieser Methoden in einem mehrphasigen Ansatz sind wir in der Lage, die Diversität von Gemeinschaften zu beurteilen, Genome zu rekonstruieren, Stoffwechselvorhersagen zu treffen, funktionelle Fähigkeiten zu testen und Zellen bestimmter Populationen zu visualisieren und zu zählen.
Eine der grundlegenden Komponenten, die in der Ökologie und insbesondere in der mikrobiellen Ökologie gemessen wird, ist die Abundanz einer bestimmten Population in der Umwelt. Vereinfacht gesagt: Je mehr Individuen vorhanden sind, desto wichtiger sind sie für das Ökosystem und desto größer ist der Einfluss auf den Nährstoffkreislauf, die Ressourcenexploration und die metabolischen Interaktionen. Ein unverzichtbares Werkzeug für die Zählung taxonomisch genau definierter Mikroorganismen ist die Hybridisierung durch FISH und Mikroskopie. Da die meisten Mikroben aufgrund ihrer Morphologie nicht zu unterscheiden sind, ist der einzige verlässliche Marker das ribosomale RNA-Molekül, das hoch konserviert und in jedem Organismus reichlich vorhanden ist. Mit Hilfe kleiner fluoreszenzmarkierter Oligonukleotide, die komplementär zur rRNA sind, können wir Sonden spezifisch für die interessanten Taxa maßschneidern. Diese können wir mittels Epifluoreszenzmikroskopie sichtbar machen und zählen. Neben der reinen Quantifizierung liefert FISH einen Hinweis auf zelluläre Strukturen und physikalische Interaktionen mit anderen Mikroben. Zur Visualisierung können hochauflösende Mikroskope wie die konfokale Laser Scanning Mikroskopie (CLSM) und STimulated Emission Depletion (STED) Mikroskopie eingesetzt werden. Außerdem können FISH-Bilder verwendet werden, um Zellgrößen zu bestimmen und Biovolumina zu berechnen, was letztlich eine Abschätzung der gesamten Biomasse der zu untersuchenden Mikrobengruppe in einer Umgebung ermöglicht.
Funktionelle Charakterisierung
Die rasante Entwicklung im Bereich der Sequenzierung hat eine neue Ära für die Untersuchung des genetischen Potenzials mikrobieller Gemeinschaften eingeläutet.
Von der DNA Analyse einzelner Populationen in der Natur bis hin zu Isolaten im Labor erlaubt uns der Einsatz von Multi-omic Techniken die Integration genetischer Informationen auf Gen-, Transkript- und auch Proteinebene. Unser Ziel ist es, die Lücke zwischen vorhergesagter Funktion und gemessener mikrobieller Aktivität durch die Integration der verschiedenen Informationsebenen zu schließen.
Die mRNA von Arten innerhalb mikrobieller Gemeinschaften verrät uns, welche Gene aktiv transkribiert werden, während die Metaproteomik die reichlich vorhandenen Proteine identifiziert. Die Kombination dieser Beobachtungen ermöglicht es uns, die Stoffwechselprozesse vorherzusagen. Die ist nur erschwert durch die Tatsache, dass wir bei der Hälfte der Proteine ihren Nutzen nicht kennen. Aber das gesammelte Wissen der Menschheit erlaubt uns einen ersten Blick auf neuartige Ökosysteme. Mit Experimenten in denen wir untersuchen, wie die mikrobielle Gemeinschaft auf spezielle Substrate reagiert und der Untersuchung bisher unbekannter Bakterien- und Archaeenstämme streben wir ein vollständiges Verständnis der wichtigsten Prozesse in der Natur an. Wir sind immer noch Entdecker.



