- Abteilungen
- Abteilung Molekulare Ökologie
- Von der Küste bis ins offene Meer
Von der Küste bis ins offene Meer

Frühlingsblüten auf Helgoland
Jedes Jahr im Frühjahr, mit zunehmendem Sonnenlicht, beginnen Kieselalgen und andere Mikroalgen in der Nordsee zu wachsen. Sie bilden schnell Blüten, die vom Weltraum aus sichtbar sind und von globaler Bedeutung für den Kohlenstoffkreislauf sind. Große Mengen an CO2 werden der Atmosphäre entzogen und in der Algenbiomasse fixiert, meist als Polysaccharide und Proteine.
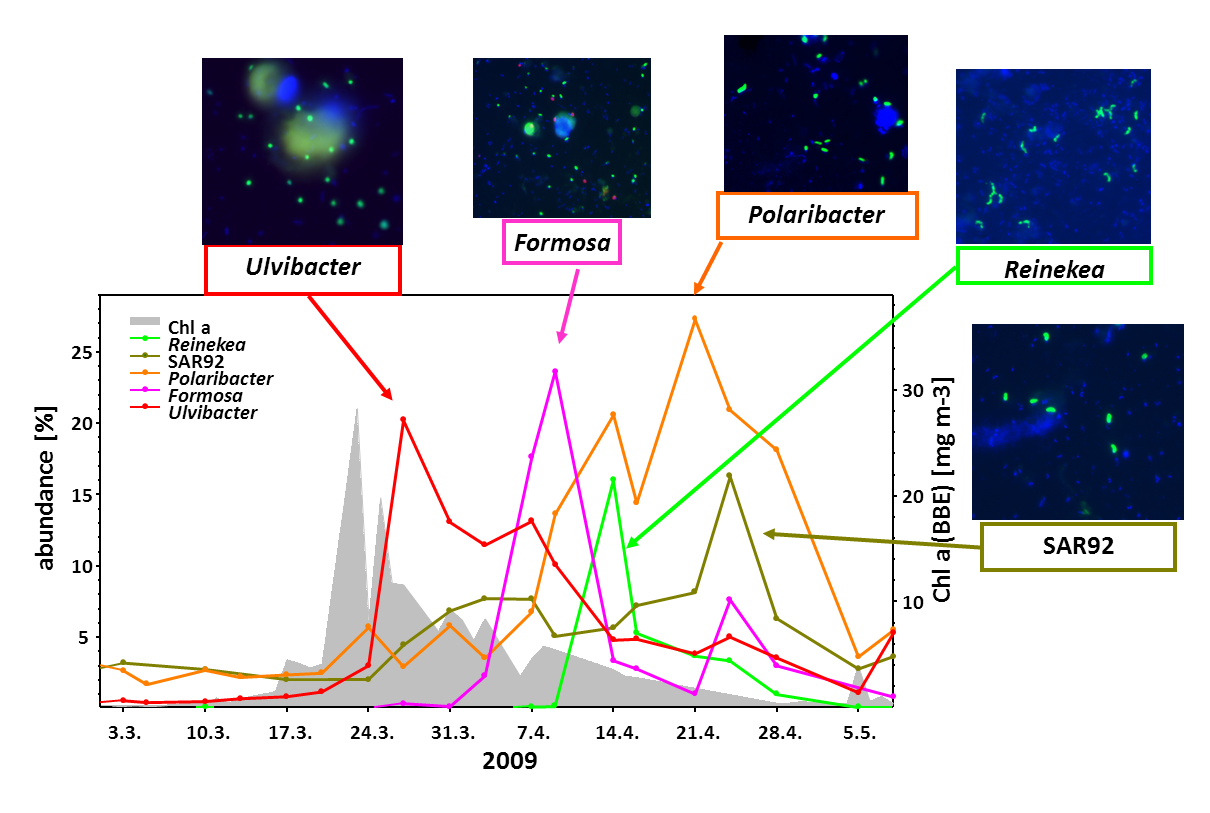
Innerhalb weniger Wochen werden die Algenblüten nährstofflimitiert und brechen schließlich durch Abweiden und Virenbefall zusammen. Wie remineralisieren welche Meeresbakterien diese Algenbiomasse und setzen dabei einen Großteil des CO2 frei? Diese wichtige Forschungsfrage wurde in den letzten Jahren sehr detailliert erforscht. In einer datenreichen Studie (Teeling et al., 2016) konnten wir zeigen, dass in vier Folgejahren die gleichen Bakteriengattungen von der Algenbiomasse profitieren.
Polysaccharid-Verwertungs-Loci
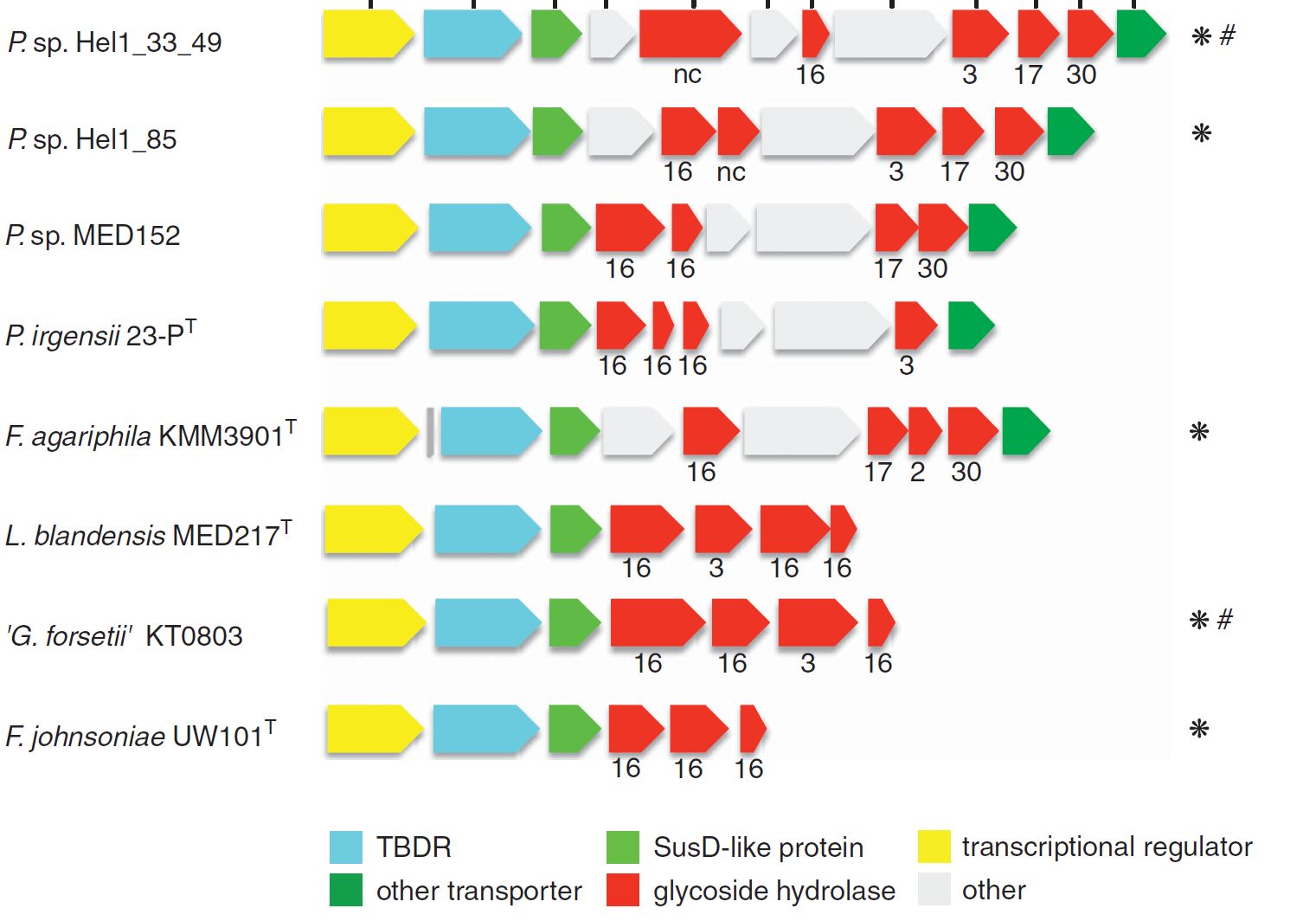
Große Operons, die für kohlenhydrataktive Enzyme (CAZyme) kodieren, sogenannte Polysaccharid-Utilisation-Loci (PULs), sind nicht nur ein Markenzeichen von Darm-Bacteroidetes, sondern auch der Schlüssel zur Substratspezialisierung von marinen Flavobakterien.
Letztes Jahr haben wir PULs aus kontrastreichen Oberflächengewässern des Nordatlantiks publiziert (Bennke et al. 2016), und analysieren derzeit 44 Metagenome, die aus den Frühjahrsblüten 2009-2012 gewonnen wurden (Krüger et al. unveröffentlicht). Zusätzlich wurden etwa 200 PULs in den Genomen von 60 Flavobakterien-Isolaten aus der Nordsee durch die Gruppe von Jens Harder identifiziert (Kappelmann et al. unveröffentlicht).
Eigennützige Bakterien
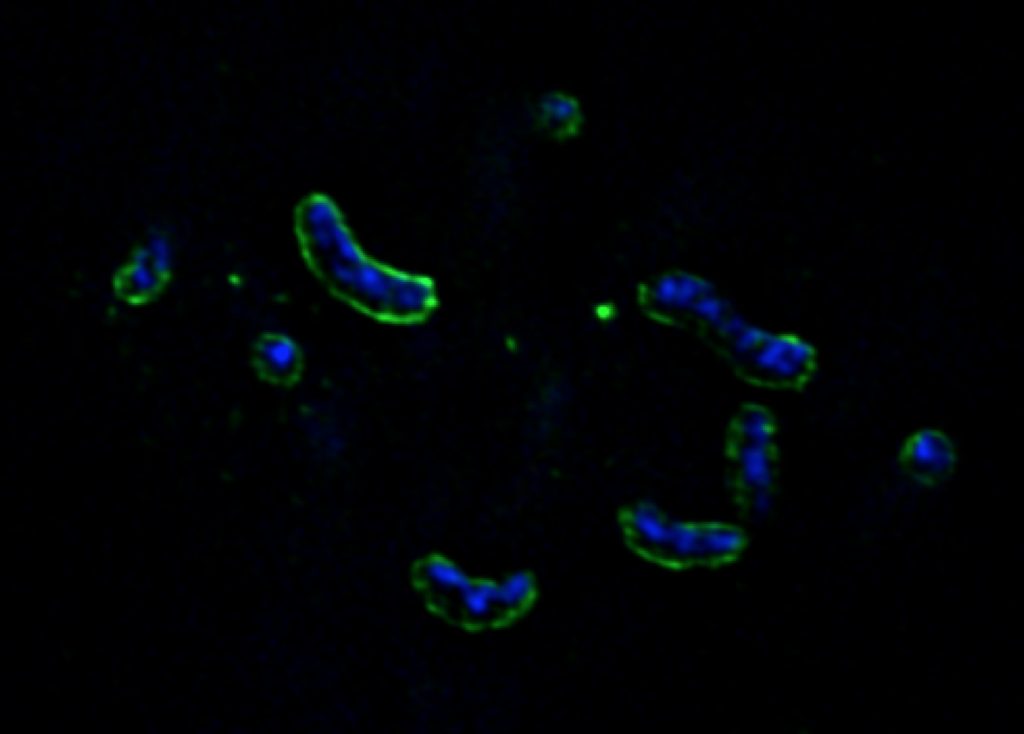
Durch einen glücklichen Zufall entdeckten wir, dass die Verwertung von fluoreszenzmarkierten Polysacchariden durch Lichtmikroskopie sichtbar gemacht werden kann (Reintjes et al., 2017). Flavobakterien binden und bauen Polysaccharide teilweise an der äußeren Membran ab, von wo aus große, noch fluoreszenzmarkierte Oligosaccharide über TonB-abhängige SusC-Transporter schnell in den periplasmatischen Raum aufgenommen werden (siehe rechts). Erst in diesem diffusionsgeschützten Raum erfolgt der Abbau zu Mono- und Disacchariden, die schließlich über die innere Membran ins Zytoplasma transportiert werden. Dieser Mechanismus wurde als "egoistische" Polysaccharidverwertung bezeichnet, da er den Verlust von CAZyme und das "Teilen" von Abbauprodukten mit "betrügerischen" Bakterien vermeidet.
Aggregate
Oberflächengewässer sind durch ein Kontinuum an organischer Materie gekennzeichnet, das von gelösten Molekülen bis hin zu Partikeln reicht, die sichtbare marine Aggregate bilden können. Solche Partikel stellen Hotspots des mikrobiellen Lebens dar. Wir testeten die Hypothese, dass sich die mikrobiellen Gemeinschaften in der 0,2-3 µm großen Fraktion, die mit freilebenden Bakterien angereichert ist, grundlegend von denen unterscheiden, die auf Filtern mit einer Porengröße von 3, 5 oder 10 µm gesammelt wurden und die hauptsächlich partikelassoziierte Mikroorganismen widerspiegeln. Zwei rRNA-basierte taxonomische Studien, die diese Hypothese unterstützen, wurden im Berichtszeitraum abgeschlossen. Sie wurden in küstennahen marinen und limnischen Gewässern (Bizic-Ionescu et al., 2014) und im westafrikanischen Auftriebsgebiet (Thiele et al., 2015) durchgeführt und gehen zukünftigen Studien voraus, in denen wir das genomische Repertoire, insbesondere das PUL-Spektrum von freilebenden und partikelassoziierten Bakterien untersuchen wollen.